| |
 |
| |
 |
| |
| ● 用語の定義 |
| 理論空気量 (=酸素量/21%) |
| 理論湿り排ガス量(炉内) |
| 理論渇き排ガス量(大気放散後) |
| 発熱量: 高位発熱量(炉内) |
| 低位発熱量(真発熱量) 大気放散後、環境中 |
| ● 気体燃料データベース |
| ● 硫黄分について |
| SOXの化学平衡比率 |
| 装置の硫酸腐食 |
| |
 |
| ● 用語の定義 |
| |
| 水素、都市ガス、プロパンガス、天然ガスなどが気体燃料です。ほとんどの気体燃料は、可燃性ガス元素の混合物です。発熱量、排ガス量、燃焼に必要な空気などは、元素ごとに決まっていて、燃料としての数値は、混合割合に比例します。 |
| |
| それぞれの元素の燃焼を化学式で表現すれば、その係数で必要な酸素量、排ガス量がわかります。酸素量から燃焼に必要な空気量が計算できます。化学式は、モル数で表現されています。全部の気体は、1モル当たりの体積が同じなので、モル数は体積比率と考えて差し支えありません。 |
| |
 |
| 〇 Ao; 理論空気量 (=酸素量/21%) |
| |
| 理論空気量は、燃焼の化学式の必要酸素量を、空気の酸素含有率で除算したものになります。酸素含有率は21%でいいと思いますが、正確には、20.95%だそうです。 |
| |
| Ao = 酸素モル係数 / 大気中酸素濃度 |
| |
 |
| 〇 Gow: 理論湿り排ガス量(炉内) |
| |
| 水素が燃えると水(水蒸気)になりますが、湿り排ガス量は、この水蒸気を含んだ数値という意味です。工業的には、加熱炉内ではこの状態です。家庭でガスコンロを使って料理する場合も、この状態で利用します。 |
| |
| Gow = Ao + CO2係数 + H2O係数 - O2係数 |
| |
 |
| 〇 God: 理論渇き排ガス量(大気放散後) |
| |
| 排ガスは、燃焼ガスを利用した後、大気中に放出され、温度が下がって大気温度になります。燃焼でできた水蒸気は液体の水に戻ると考えられ、環境中に残る排ガスは、水蒸気を除いた数値になります。これを渇き排ガス量といいます。したがって、湿り排ガス量から水分を引いた数値になります。 |
| |
| God = Gow - H2O係数 |
| |
 |
| 〇 発熱量: 高位発熱量(炉内) |
| |
| このホームページは、熱力学なので、燃焼ガスが仕事をする状態の発熱量を扱いたいと思います。これは、湿り排ガスの時の発熱量で、高位発熱量といいます。 |
| |
 |
| 〇 低位発熱量(真発熱量) 大気放散後、環境中 |
| |
| 加熱などの仕事が済んだあと、排ガスは大気中に放散されて水分が除去されます。この、渇き排ガスになったときの発熱量を低位発熱量、もしくは真発熱量と言います。熱力学では使わないので、ここでは割愛します。 |
| |
 |
| ● 気体燃料データベース |
| |
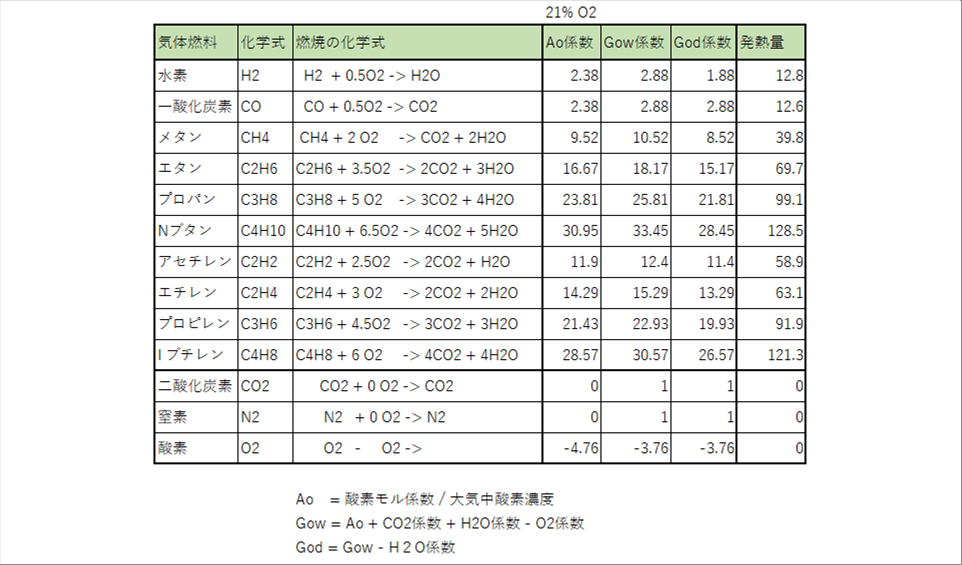
| 下の表は、主な可燃性ガス元素の燃焼に必要な空気、理論排ガス量、発熱量などのデータベースです。製造上の何らかの理由で、二酸化炭素、窒素、酸素が含まれる場合があるので、参考までに入れてあります。 |
| |
 |
| |
| 二酸化炭素と窒素は燃えないので、理論空気量はゼロですが、そのまま排ガスになるので、排ガス量の係数は、1となります。 |
| |
| 酸素の符号はマイナスになっていますが、これは、酸素が気体燃料に含まれていると、燃焼に使えるため、空気(の酸素)が省略できるという理由です。 |
| |
 |
| ● 硫黄分について |
| |
| 気体燃料には、ごく微量の硫黄Sが含まれる場合があります。硫黄分は、燃焼して硫黄酸化物SOXになります。 |
| |
| SOXの主成分は、2酸化硫黄SO2と3酸化硫黄SO3ですが、比率は温度によって変わります。これを「平衡状態」と言います。興味深い現象ですが、硫黄分はごく微量なので、熱計算にはほとんど影響しません。 |
| |
| 硫黄酸化物SOXは、大気汚染防止と、加熱炉、熱処理炉の温度交換器の硫酸腐食の観点からは、大変重要な要素です。 |
| |
 |
| 〇 SOXの化学平衡比率 |
| |
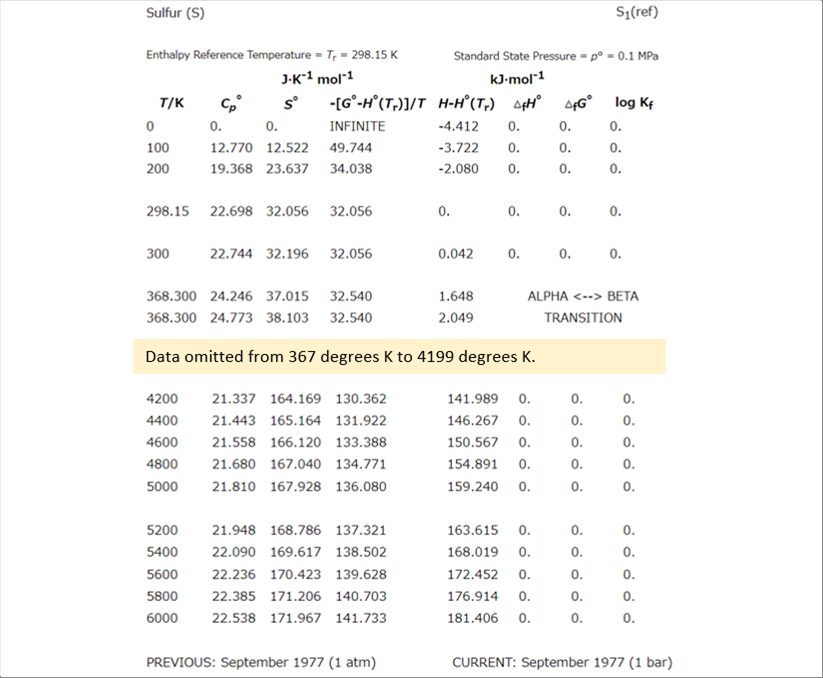
| 化学平衡比率は、NIST-JANAF Thermochemical Tables を参照しました。NIST : National Instutite of Standards and Technology, U.S. Department of Commerce |
| |
| 結論から言うと、室温ではSO3、高温ではSO2が主成分となります。 |
| |
| NISTのデータは、テキストの表で提供されているので、コピペしてエクセルなどで計算が可能です。 |
| |
 |
| |
| このデータをもとにして、SO2とSO3の化学平衡比率を求めて、燃料起因のSOXが計算できます。 |
| |
| 化学平衡はここの本題ではないので省略しますが、次の3個の平衡式が既知なので、SO2とSO3の平衡式が導出できます。既知の平衡式の1個目は、S、酸素、SO3の平衡式、2個目がS、酸素、SO2の平衡式、3個目は、SO2、酸素、SO3の平衡式です。 |
| |
| K = Kf[SO3] / Kf[SO2] |
| |
| K = 10 ^ (logKf[SO3] - logKf{SO2]) |
| |
| NISTのデータのうち、加熱炉、熱処理炉などで利用する温度範囲のデータを使わせていただきます。 |
| |
 |
| 〇 装置の硫酸腐食 |
| |
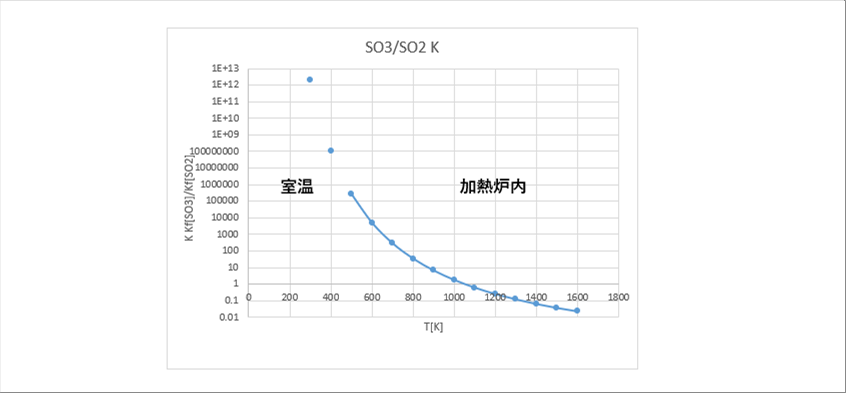
| 室温から、加熱炉で使う程度の温度範囲にしたグラフが下のグラフです。 |
| |
 |
| |
| 室温では全量SO3といってもいいと思います。次に、加熱炉内の状況を見てみましょう。炉内の温度範囲では、SO3が急激に減少します。これは、SO2が急激に増加するためで、700度C(1100K)で半々になり、1200度C(1500K)で90%ほどがSO2になっていることがわかります。 |
| |
| 排ガス熱回収装置の低温部では、SO3が多いことがわかります。SO3は水にとけると硫酸になるため、低温部では硫酸腐食が進行すると考えられます。 |
| |
| |
| Author: T.Oda |
| このページはエクセルで作り、excel2webでhtmlとcssを自動作成しました。 |





























