| |
 |
| |
 |
| ● はじめに |
| ● 燃焼炎とは |
| ● 燃料ガスの成分 |
| ● ガスの発熱量 (高位発熱量) |
| - 都市ガスの発熱量 |
| - 高位発熱量と低位発熱量(真発熱量)シミュレーションに使うのはどっち。 |
| - 燃料の硫黄 |
| ● 理論空気量、理論排ガス量 |
| - 空燃比 |
| ● 強制対流熱伝達率は必要か |
| ● 燃焼の化学 |
| |
 |
| ● はじめに |
| |
| 対流による熱伝達は燃焼ガスなど、炉内の流体速度によってかわります。対流には自然対流と強制対流があります。シミュレーションは、自然対流は文字通り自然に発生しているので、必須です。強制対流はどうでしょうか。燃焼ガスはバーナーから、炉内を通って煙突から出ていきます。炉内断面積が小さく、燃焼ガス量が多いとガス速度が速くなりますが、粘性のために、炉の天井と床の中間で最大速度で、炉壁では速度がゼロになります。被加熱材をどこに置くかによりますが、炉床の近くに置く場合は、速度は無視できるほど小さくなると推測されます。温度シミュレーションをする際に、燃料の燃焼からやる場合はほとんどないと思いますが、燃焼と排ガス速度の概要を理解することは意味があると思われます。 |
| |
| 燃料組成、空燃比による発熱量の計算と、排ガス量(断面積で割ると平均排ガス速度が得られる)の計算方法をまとめました。 |
| |
 |
| ● 燃焼炎とは |
| |
| 燃料は、石炭などの固体燃料、灯油・ガソリンなどの液体燃料、水素・プロパンガスなどえの気体燃料がありますが、ここでは気体燃料を説明していきます。 |
| |
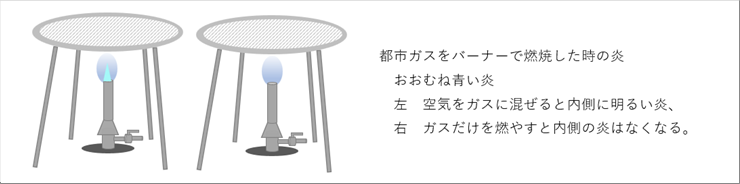
| 都市ガスをガスバーナーで燃焼させると、青い炎が見られます。バーナーの空気口を開けて、都市ガスと空気を混合した炎は、内側に明るい部分が見え、空気口を閉じると、明るい部分はなくなります。 |
| |
 |
| |
| 空気口の開閉で炎の様子が違うので、事前に空気と混合した場合とガスだけを燃焼させた場合では、燃焼過程に差があることは想像できます。ちなみに、都市ガスの代わりに、プロパンガスを燃焼しても同様の炎が観察さるので、同様の燃焼過程になっていると推測されます。 |
| |
| 加熱炉で素材の鉄を加熱する場合も同様の燃焼過程になりますが、加熱炉は上の絵より密閉性が高いので、周囲の空気をあてにする右のような使い方は、せず、事前に燃料ガスに空気を混合させる左のような使い方をするのが主流だと思います。 |
| |
| ここでは、炎の色や、燃焼前に燃料ガスと空気を混合する方法などは割愛して、燃料が燃えたときに発生する熱量と、生成物を考えていきたいと思います。 |
| |
 |
| ● 燃料ガスの成分 |
| |
| 気体燃料は、都市ガス、プロパンガスなどですが、計算にはその組成が重要です。燃料ガスは、可燃性ガスと、非可燃性ガスが混在していると思いますが、全部計算に使います。 |
| |
| 可燃性ガスとしては、水素、メタン、プロパンなどは有名ですが、一酸化炭素も燃やすことができます。水素は水に、一酸化炭素は二酸化炭素になります。そのほかのプロパンなどは炭化と水素の化合物なので、二酸化炭素と水ができます。水は、燃焼時には水蒸気で、冷えると液体の水になります。 |
| |
 |
| |
| 非可燃性ガスとしては、二酸化炭素、窒素ですが、酸素も燃えません。燃料の燃焼のために空気を使いますが、燃料ガスの酸素も使えますので、その分は空気を節約できます。 |
| |
 |
| ● ガスの発熱量 (高位発熱量) |
| |
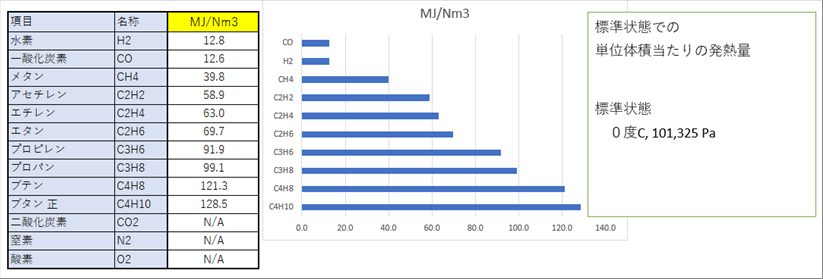
| 都市ガス、プロパンガスなど、一般的に使われている燃料ガスの可燃性成分を構成している元素は、炭酸と水素です。これらは、酸素で酸化されて、その際に発熱します。水素は水になり、炭素は、二酸化炭素になります。 |
| |
 |
| |
| 一酸化炭素の発熱量は、水素とほぼ同じです。また、プロパンは水素の約9倍の発熱量があることなどがわかります。 |
| |
| それぞれの物質の単位体積あたりの発熱量は決まっているので、成分とその比率がわかれば発熱量が計算できます。 |
| |
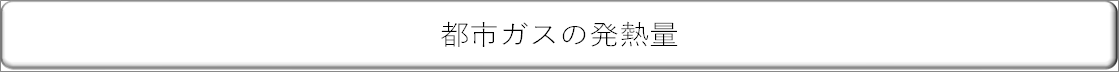 |
| ● 都市ガスの発熱量 |
| |
 |
| |
| 東京ガス様のウェブサイトによると、発熱量と組成は上のように記載されています。 |
| |
| この組成を、先ほどの表の単位体積当たりの発熱量に当てはめて計算計算すると、44.8 メガジュールになりました。東京ガスの公称値は45メガジュールなので、ほぼ同じ数値になりました。 |
| |
 |
| ● 高位発熱量と低位発熱量(真発熱量)シミュレーションに使うのはどっち。 |
| |
| 両者の定義は、次のようになります。 |
| |
| 高位発熱量 = 燃焼直後の発熱量 |
| 低位発熱量 = 燃焼前の状態に戻ったときの発熱量 = 真発熱量 |
| |
| 低位発熱量は真発熱量ともいうので、こちらが正しい数値と思われる方もおられる(私が最初そうでした。。。)と思いますが、シミュレーションでは、高位発熱量を使うのが正解です。それは、次のような理由によります。 |
| |
| 燃料を燃やすと発熱して、高温の二酸化炭素と水蒸気が発生します。。これを高位発熱量といい、熱量計で計測している熱量は高位発熱量です。火力発電所のタービン、バイクのエンジン、や、加熱炉が仕事をするのはこの状態です。 |
| |
| 仕事の後、煙突、排気管から出た二酸化炭素と水蒸気は、徐々に冷えて燃焼前の温度にもどります。高温の水蒸気が水になるために熱量が使われるので、低位発熱量は、高位発熱量より小し値になりますが、元の温度に戻っても発熱量が残りますので、これを真発熱量といいます。 |
| |
| 温度シミュレーションは、燃焼空気が仕事をしている最中のことが知りたいので、シミュレーションには、高位発熱量を使用します。先ほどの都市ガスの熱量も、燃焼時の熱を料理などに利用するので、高位発熱量を使っておられます。 |
| |
 |
| ● 燃料の硫黄 |
| |
| 気体ではありませんし、意図的に添加するのでもありませんが、燃料ガスには、微量の硫黄分が含まれている場合があります。 |
| |
| 硫黄も燃やすことができるので、可燃成分になります。燃焼すると硫黄酸化物になります。これは亜硫酸ガスといわれるもので、温度が下がって水にとけると亜硫酸、硫酸になります。 |
| |
| 亜硫酸、硫酸は、炉の機械構造物を容易に腐食します。被加熱材の温度シミュレーションをするだけなら硫黄は無視しても計算結果に影響はほとんどありませんが、排ガスの熱回収装置などがついている炉では、熱回収装置の低温部の腐食と原因となるので、留意しておいたほうがいい点となります。 |
| |
 |
| ● 理論空気量、理論排ガス量 |
| |
| 気体燃料を過不足なく燃焼させる空気量を理論空気量、生成された水蒸気と二酸化炭素の量を理論湿り排ガス量と言います。燃焼時は高温なので、「湿って」いるわけではなく、燃焼の水蒸気が含まれているという意味です。 |
| |
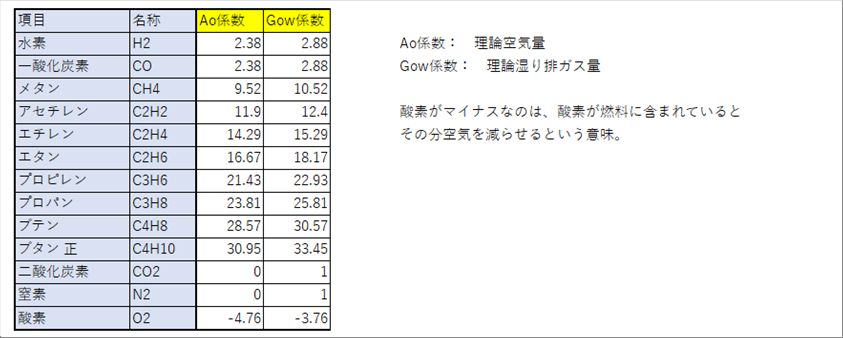 |
| |
| 発熱量と同様、燃料の体積比率をかければ、完全燃焼させるための空気量と、総排ガス量が計算できます。 |
| |
| 東ガス様の都市ガスの場合、都市ガス1に対して理論空気量は11、排ガス量は12となります。 |
| |
 |
| ● 空燃比 |
| 理論空気量の何倍の空気を使っているかの比率を空燃比といいます。 |
| |
| 不完全燃焼しないように、通常は1より大きな数値にします。この過剰分は、そのまま排ガスに加算されます。 |
| |
 |
| ● 強制対流熱伝達率は必要か。 |
| 炉のシミュレーションでは、炉がある程度大きければ、発生する燃焼ガス(=排ガス)の量が炉の大きさに対して小さいので、自然対流の場合の伝熱係数を使って大きな問題はないと思いますが、炉の内容積が小い場合には、燃焼ガスの流速が無視できないくらい大きい可能性もあるので、その際は強制対流の場合の熱伝達係数を計算する必要があるかもしれません。 |
| |
| 例 都市ガス使用量: 100〜1000m3/h, 空燃比: 1.2、 炉の断面積 5m2 |
| |
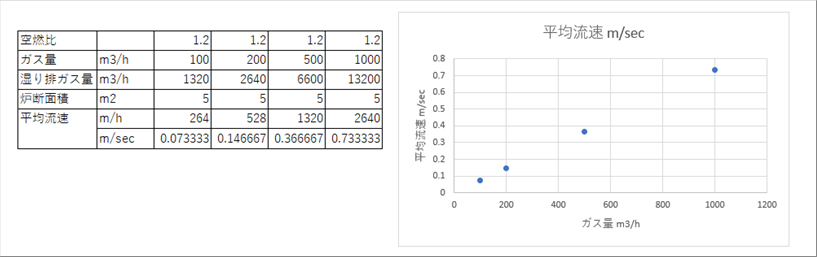 |
| |
| 単位時間内のガス使用量が増えると、平均流速が上がります。必要であれば、強制対流の熱伝達係数を使う必要が出てくると思われます。 |
| |
 |
| ● 燃焼の化学 |
| 以上の計算は、化学式が元になっています。興味がある方はご一読ください。 |
| |
| 可燃性ガスは、酸素と反応して二酸化炭素と水(水蒸気)になり、その際に発熱します。一例としてメタンCH4を例にして化学式で表現すると次のようになります。 |
| |
| CH4 + 2O2 -> CO2 + 2H2O + 891 kJ |
| |
| 発熱量は化学式の最後に書いてあります。上のまとめ表では39.8MJ/Nm3となっていますが、化学式はモル表記のため891kJ/molです。 |
| |
| モル数は、日常生活で使うことがほとんどないので、簡単にまとめておきます。モルは、物資が分子(金属は原子)でできているという考え方に基づいているそうです。 |
| |
| CH4 + 2O2 -> CO2 + 2H2O + 891 kJ |
| |
| 化学式は、メタン分子1個と、酸素分子2個が過不足なく結合して、二酸化炭素分子1個と、水分子2個ができることを表現しています。絵にすると下のようになります。 |
| |
| 茶色のボールが炭素原子(直径0.15nm)、青のボールが水素原子(直径0.12nm)、緑のボールが酸素原子(直径0.14nm)を表しています。 |
| |
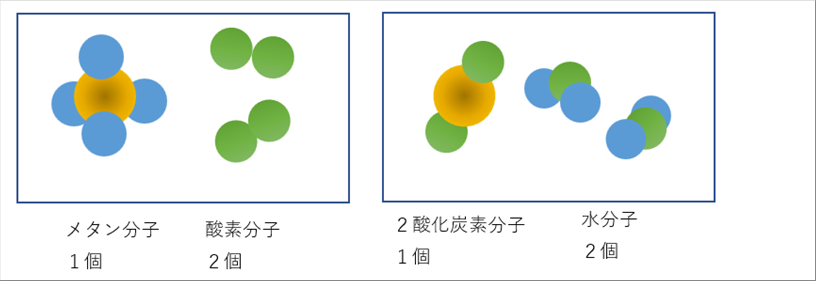 |
| |
| 化学式は、左の箱の分子が右の箱の分子になり、この際に発熱することを表しています。問題は、1個の大きさが極めて小さいことです。炭素原子の直径は0.15nm(ナノメートル)ですが、1000nmが1μm(ミクロン)なので、0.15nmはテニスボールの数億分の1くらいです。したがって、分子1個の発熱量は極めて小さい数字になります。 |
| |
| では、何個くらいが妥当なのでしょうか。 |
| |
| 考案されたのがモルという単位で、物質の質量数にグラムをつけた数値です。物質の質量数は、陽子と中性子を足した数値なので、1モルには、どんな物質でも同じ個数の分子(金属は原子)が含まれていることになります。ちょっと脱線しますが、酸素原子を例にとって、質量数のイメージをつかんでいただきたいと思います。 |
| |
| 原子は、原子核と電子でできており、原子核は、陽子と中性子でできています。電子の質量は非常に小さいので、原子の質量は大部分が陽子と中性子の質量です。 |
| |
| 質量数=陽子数+中性子数 |
| |
 |
| |
| 異なる物質の1つの原子は、別の陽子数、中性子数でできていますが、一つの原子には変わりありません。異なる物質でも同じ陽子と同じ中性子でできているので、質量数にグラムをつけると、同じ原子数の物質を扱うことになります。これが1モルの定義です。 |
| |
| メタンガスの燃焼で関係する物質の1モルは、水素1モル=1g、酸素1モル=16g、炭素1モル=12gです。化学式(箱)は、メタン1モル12g+4g=16g、酸素2モル 2 x 32g = 64g 、合計80g が、二酸化炭素1モル 12g+2x16g=44g、水2モル 2x(2g+16g)=36g、合計80gになり、891kJ発熱することを表しています。 |
| |
| 体積では、メタン1モル22.4リットル、酸素2モル 2x22.4 = 44.8リットル 、合計67.2リットルが、二酸化炭素1モル 22.4リットル、水2モル 2x22.4 = 44.8リットル 、合計67.2リットルになり、891kJ発熱することを表しています。燃料はNm3で計測することが多いので、これを1Nm3あたりに換算したのが上の表です。 |
| |
| メタン1Nm3発熱量 891*10^(-3)MJ / ( 22.4*10^(-3) ) Nm3 = 39.8 MJ/Nm3 |
| |
| Author: T. Oda |
| このページはエクセルで作り、excel2webでhtmlとcssを自動作成しました。 |